
Kratek povzetek
Uvodne informacije
Virusi influence A po vsem svetu povzročajo okužbe, zaradi katerih vsako leto umre pol milijona ljudi. Izbruhi gripe se pojavljajo v zimskih mesecih v regijah z zmernim podnebjem.
Na severni polobli dosežejo vrhunec med novembrom in marcem, na južni polobli pa med majem in septembrom. Na te epidemije vplivajo temperaturna nihanja, nizka zračna vlaga, preveliko število oseb v zaprtih prostorih, pomanjkanje sončne svetlobe in s tem povezano pomanjkanje vitamina D.
Rezultat
Obširna študija profesorice Akiko Iwasaki in sodelavcev je ponovno pokazala*, da prenizka zračna vlaga pomembno poveča dovzetnost za okužbe z virusom influence.
(*Lipsitch idr., 2010, 30-letna študija)
Prenizka, 10- do 20-odstotna relativna zračna vlaga oslabi samočistilni mehanizem dihalnih poti, zmanjša odpornost proti virusom in oslabi delovanje spominskih celic imunskega sistema. Pri višji relativni zračni vlagi (50 %) do navedenih oslabitev ne pride.
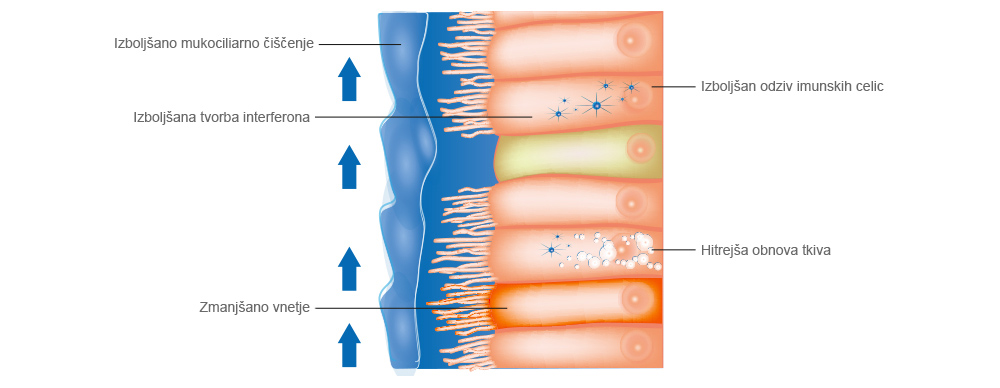
Tri pregrade imunskega sistema za zaščito pred okužbami
Zaščita pred virusno okužbo je naloga treh pregrad imunskega sistema. Prvo pregrado sestavljajo plast sluzi, plast tekočine na plasti sluzi in migetalke na površini. Te omogočajo obrambo pred povzročitelji bolezni in delci, ki pridejo v telo prek dihalnih poti. Če virus prodre skozi prvo pregrado imunskega sistema, se začne izločati interferon, ki aktivira gene za boj proti virusom oziroma njihovo blokado. Če virusu uspe prodreti tudi skozi to prirojeno drugo pregrado, se kot tretja pregrada aktivira adaptivni imunski sistem, da izzove imunski odziv spominskih celic T in B, specifičnih za virus.
Če se zadržujemo v prostorih s prenizko relativno zračno vlago (10–20 %), te tri pregrade ne delujejo. Gripa izbruhne. Bolezen se pri 10- do 20-odstotni relativni zračni vlagi poslabša ne glede na virusno obremenitev. Poleg tega se celično tkivo ne more obnavljati.
Pri 50-odstotni relativni zračni vlagi gripa poteka v blažji obliki, telesna temperatura je manj povišana in bolezen traja krajši čas.
Študija dr. Akiko Iwasaki
Vpliv zračne vlage na imunski sistem
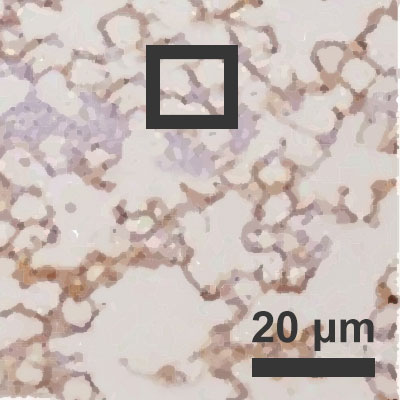 Okuženi pljučni mešički pri
Okuženi pljučni mešički pri 10-odstotni zračni vlagi
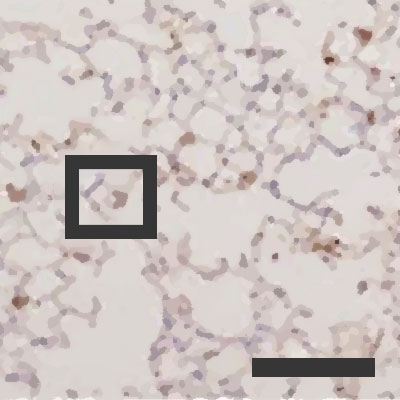 Okuženi pljučni mešički pri
Okuženi pljučni mešički pri 50-odstotni zračni vlagi
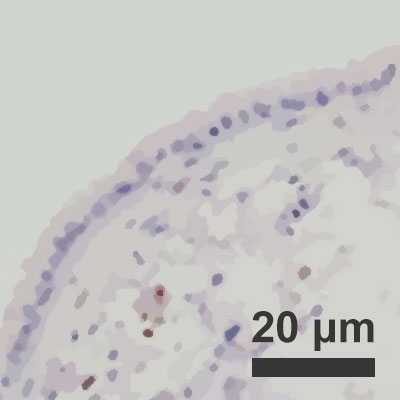 Obnavljanje okuženih pljučnih mešičkov pri 10-odstotni zračni vlagi
Obnavljanje okuženih pljučnih mešičkov pri 10-odstotni zračni vlagi
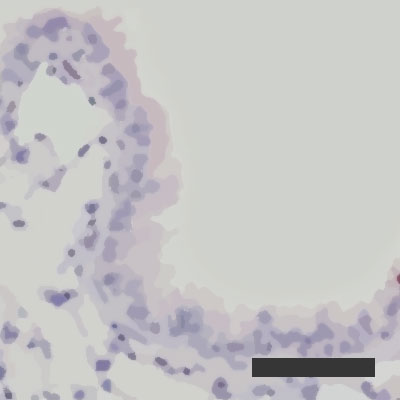 Obnavljanje okuženih pljučnih mešičkov pri 50-odstotni zračni vlagi
Obnavljanje okuženih pljučnih mešičkov pri 50-odstotni zračni vlagi
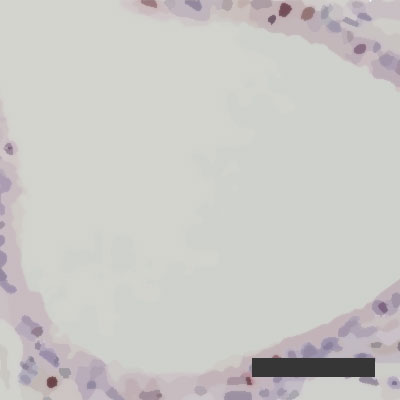 Obnavljanje okuženih pljučnih mešičkov pri 10-odstotni zračni vlagi
Obnavljanje okuženih pljučnih mešičkov pri 10-odstotni zračni vlagi 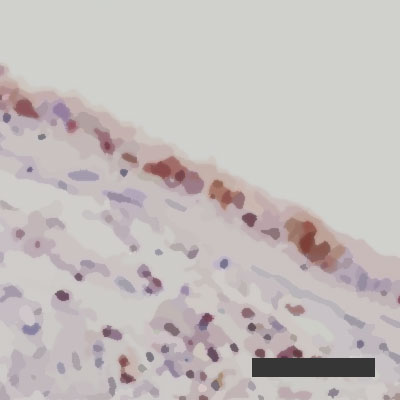 Obnavljanje okuženih pljučnih mešičkov pri 50-odstotni zračni vlagi
Obnavljanje okuženih pljučnih mešičkov pri 50-odstotni zračni vlagi
Vprašanji, zastavljeni Dr. Akiko Iwasaki
Kako uravnotežena zračna vlaga v prostoru vpliva na osebe, izpostavljene virusu gripe?
Kateri so zaščitni mehanizmi uravnotežene zračne vlage?
Že desetletja vemo, da se valovi gripe pojavljajo predvsem pozimi, ko je treba ogrevati notranje prostore. Potekale so burne razprave o tem, kateri so možni vzroki za obolevanje ljudi za gripo v zimskem času. Razlage za sezonski značaj, ki jih navajajo, so med drugim izpostavljenost nizkim temperaturam in nizki zračni vlagi v zaprtih prostorih in tudi na prostem, veliko število ljudi v zaprtih prostorih s povečano možnostjo kontaktnega ali kapljičnega prenosa bolezni, zmanjšanje ravni vitamina D v krvi zdravega človeka zaradi manjše količine sončnih žarkov.
Razumevanje vzrokov sezonske gripe in posledična seznanjenost z ukrepi, s katerimi je mogoče zmanjšati z okužbo povezano verjetnost obolenj in smrti, nista zanimiva samo s teoretičnega vidika. Tema je izjemno pomembna, saj se število sezonskih okužb z virusom gripe še naprej povečuje, zaradi teh okužb pa vsako leto po vsem svetu umre najmanj pol milijona ljudi. Zagotavljanje uravnotežene zračne vlage je zaščitni ukrep, ki podpira cepljenje in bi lahko rešil na milijone človeških življenj.
Študija kaže, da suh zrak v zaprtih prostorih poveča posledice gripe. Dokazano je bilo tudi, da se z uravnavanjem relativne zračne vlage na 40 do 60 odstotkov zelo zmanjša možnost okužbe z virusi in oteži postopek prenosa bolezni. To je prva študija, ki opisuje fiziološke mehanizme v ozadju pozitivnih rezultatov, ki jih dosežemo z uravnoteženim vlaženjem zraka.
Kako uravnotežena zračna vlaga v prostoru vpliva na osebe, izpostavljene virusu gripe?
Kateri so zaščitni mehanizmi uravnotežene zračne vlage?
Že desetletja vemo, da se valovi gripe pojavljajo predvsem pozimi, ko je treba ogrevati notranje prostore. Potekale so burne razprave o tem, kateri so možni vzroki za obolevanje ljudi za gripo v zimskem času. Razlage za sezonski značaj, ki jih navajajo, so med drugim izpostavljenost nizkim temperaturam in nizki zračni vlagi v zaprtih prostorih in tudi na prostem, veliko število ljudi v zaprtih prostorih s povečano možnostjo kontaktnega ali kapljičnega prenosa bolezni, zmanjšanje ravni vitamina D v krvi zdravega človeka zaradi manjše količine sončnih žarkov.
Razumevanje vzrokov sezonske gripe in posledična seznanjenost z ukrepi, s katerimi je mogoče zmanjšati z okužbo povezano verjetnost obolenj in smrti, nista zanimiva samo s teoretičnega vidika. Tema je izjemno pomembna, saj se število sezonskih okužb z virusom gripe še naprej povečuje, zaradi teh okužb pa vsako leto po vsem svetu umre najmanj pol milijona ljudi. Zagotavljanje uravnotežene zračne vlage je zaščitni ukrep, ki podpira cepljenje in bi lahko rešil na milijone človeških življenj.
Študija kaže, da suh zrak v zaprtih prostorih poveča posledice gripe. Dokazano je bilo tudi, da se z uravnavanjem relativne zračne vlage na 40 do 60 odstotkov zelo zmanjša možnost okužbe z virusi in oteži postopek prenosa bolezni. To je prva študija, ki opisuje fiziološke mehanizme v ozadju pozitivnih rezultatov, ki jih dosežemo z uravnoteženim vlaženjem zraka.
Avtorji
Izvirni naslov: Low ambient humidity impairs barrier function and innate resistance against influenza infection
Povezava do vira: www.pnas.org/content/early/2019/05/07/1902840116
Objavljeno: 13.05.2019
1. Wong GH, Goeddel DV (1986) Tumour necrosis factors alpha and beta inhibit virus replication and synergize with interferons. Nature 323:819–822.
2. Johnson NB, et al.; Centers for Disease Control and Prevention (CDC) (2014) CDC National Health Report: Leading causes of morbidity and mortality and associated behavioral risk and protective factors–United States, 2005-2013. MMWR Suppl 63:3–27.
3. Tamerius JD, et al. (2013) Environmental predictors of seasonal influenza epidemics across temperate and tropical climates. PLoS Pathog 9:e1003194, and erratum 2013 Nov;9(11).
4. Alonso WJ, et al. (2015) A global map of hemispheric influenza vaccine recommendations based on local patterns of viral circulation. Sci Rep 5:1–6.
5. Tamerius J, et al. (2011) Global influenza seasonality: Reconciling patterns across temperate and tropical regions. Environ Health Perspect 119:439–445.
6. Cannell JJ, et al. (2006) Epidemic influenza and vitamin D. Epidemiol Infect 134:1129– 1140.
7. Lowen AC, Steel J (2014) Roles of humidity and temperature in shaping influenza seasonality. J Virol 88:7692–7695.
8. Eccles R (2002) An explanation for the seasonality of acute upper respiratory tract viral infections. Acta Otolaryngol 122:183–191.
9. Shaman J, Pitzer VE, Viboud C, Grenfell BT, Lipsitch M (2010) Absolute humidity and the seasonal onset of influenza in the continental United States. PLoS Biol 8: e1000316.
10. Lowen AC, Mubareka S, Steel J, Palese P (2007) Influenza virus transmission is dependent on relative humidity and temperature. PLoS Pathog 3:1470–1476.
11. Iwasaki A, Pillai PS (2014) Innate immunity to influenza virus infection. Nat Rev Immunol 14:315–328.
12. Chen X, et al. (2018) Host immune response to influenza a virus infection. Front Immunol 9:320.
13. Garber EA, Hreniuk DL, Scheidel LM, van der Ploeg LHT (1993) Mutations in murine Mx1: Effects on localization and antiviral activity. Virology 194:715–723.
14. Staeheli P, Grob R, Meier E, Sutcliffe JG, Haller O (1988) Influenza virus-susceptible mice carry Mx genes with a large deletion or a nonsense mutation. Mol Cell Biol 8: 4518–4523.
15. Pillai PS, et al. (2016) Mx1 reveals innate pathways to antiviral resistance and lethal influenza disease. Science 352:463–466.
16. Taubenberger JK, Morens DM (2008) The pathology of influenza virus infections. Annu Rev Pathol 3:499–522.
17. Short KR, et al. (2016) Influenza virus damages the alveolar barrier by disrupting epithelial cell tight junctions. Eur Respir J 47:954–966.
18. Bustamante-Marin XM, Ostrowski LE (2017) Cilia and mucociliary clearance. Cold Spring Harb Perspect Biol 9:a028241.
19. Verhelst J, Parthoens E, Schepens B, Fiers W, Saelens X (2012) Interferon-inducible protein Mx1 inhibits influenza virus by interfering with functional viral ribonucleoprotein complex assembly. J Virol 86:13445–13455.
20. Everitt AR, et al.; GenISIS Investigators; MOSAIC Investigators (2012) IFITM3 restricts the morbidity and mortality associated with influenza. Nature 484:519–523.
21. Brass AL, et al. (2009) The IFITM proteins mediate cellular resistance to influenza A H1N1 virus, West Nile virus, and dengue virus. Cell 139:1243–1254.
22. Swiecki M, Wang Y, Gilfillan S, Lenschow DJ, Colonna M (2012) Cutting edge: Paradoxical roles of BST2/tetherin in promoting type I IFN response and viral infection. J Immunol 188:2488–2492.
23. Wang X, Hinson ER, Cresswell P (2007) The interferon-inducible protein viperin inhibits influenza virus release by perturbing lipid rafts. Cell Host Microbe 2:96–105.
24. Lenschow DJ, et al. (2007) IFN-stimulated gene 15 functions as a critical antiviral molecule against influenza, herpes, and Sindbis viruses. Proc Natl Acad Sci USA 104: 1371–1376.
25. Tang Q, Wang X, Gao G (2017) The short form of the zinc finger antiviral protein inhibits influenza A virus protein expression and is antagonized by the virus-encoded NS1. J Virol 91:e01909-16.
26. Arnheiter H, Skuntz S, Noteborn M, Chang S, Meier E (1990) Transgenic mice with intracellular immunity to influenza virus. Cell 62:51–61.
27. Kolb E, Laine E, Strehler D, Staeheli P (1992) Resistance to influenza virus infection of Mx transgenic mice expressing Mx protein under the control of two constitutive promoters. J Virol 66:1709–1716.
28. Haller O, Staeheli P, Kochs G (2007) Interferon-induced Mx proteins in antiviral host defense. Biochimie 89:812–818.
29. Allen EK, et al. (2017) SNP-mediated disruption of CTCF binding at the IFITM3 promoter is associated with risk of severe influenza in humans. Nat Med 23:975–983.
30. Randolph AG, et al.; Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) Network Pediatric Influenza (PICFLU) Investigators; Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) Network Pediatric Influenza (PICFLU) Investigators (2017) Evaluation of IFITM3 rs12252 association with severe pediatric influenza infection. J Infect Dis 216:14–21.
31. Mihaylova VT, et al. (2018) Regional differences in airway epithelial cells reveal tradeoff between defense against oxidative stress and defense against Rhinovirus. Cell Rep 24:3000–3007.e3.
32. Clary-Meinesz CF, Cosson J, Huitorel P, Blaive B (1992) Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biol Cell 76:335–338.
33. Daviskas E, et al. (1995) Changes in mucociliary clearance during and after isocapnic hyperventilation in asthmatic and healthy subjects. Eur Respir J 8:742–751.
34. Oozawa H, et al. (2012) Effect of prehydration on nasal mucociliary clearance in low relative humidity. Auris Nasus Larynx 39:48–52.
35. Moura FE, Perdigão AC, Siqueira MM (2009) Seasonality of influenza in the tropics: A distinct pattern in northeastern Brazil. Am J Trop Med Hyg 81:180–183.
36. Shek LP, Lee BW (2003) Epidemiology and seasonality of respiratory tract virus infections in the tropics. Paediatr Respir Rev 4:105–111.
37. Horisberger MA, Staeheli P, Haller O (1983) Interferon induces a unique protein in mouse cells bearing a gene for resistance to influenza-virus. Proc Natl Acad Sci USA 80:1910–1914.
38. Grimm D, et al. (2007) Replication fitness determines high virulence of influenza A virus in mice carrying functional Mx1 resistance gene. Proc Natl Acad Sci USA 104: 6806–6811.
39. Mastorakos P, et al. (2015) Highly compacted biodegradable DNA nanoparticles capable of overcoming the mucus barrier for inhaled lung gene therapy. Proc Natl Acad Sci USA 112:8720–8725.
40. Francis R, Lo C (2013) Ex vivo method for high resolution imaging of cilia motility in rodent airway epithelia. J Vis Exp, e50343.
41. Butler A, Hoffman P, Smibert P, Papalexi E, Satija R (2018) Integrating single-cell transcriptomic data across different conditions, technologies, and species. Nat Biotechnol 36:411–420.
42. Cohen M, et al. (2018) Lung single-cell signaling interaction map reveals basophil role in macrophage imprinting. Cell 175:1031–1044.e18.
43. Steuerman Y, et al. (2018) Dissection of influenza infection In Vivo by single-cell RNA sequencing. Cell Syst 6:679–691.e4.
44. Kudo E, et al. (2019) Low ambient humidity impairs barrier function, innate resistance against influenza infection. NCBI BioProject. Available at https://www.ncbi.nlm.nih.gov/ bioproject/PRJNA528197. Deposited March 20, 2019.
